p'=179 кПа.
Давление p, производимое газом на стенки сосуда, найдем из уравнения (2):
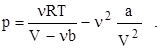
После вычисления по этой формуле получим
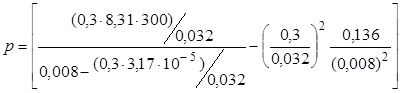 =2,84×106Па= =2,84 МПа.
=2,84×106Па= =2,84 МПа.
Подставив в выражение (3) значения р' и р и произведя вычисления, найдем
k1=6,3 %.
Следовательно, давление газа, обусловленное силами притяжения молекул, составляет 6,3 % давления газа на стенки сосуда.
Пример 12. Моль кислорода расширяется адиабатически в пустоту, в результате чего объем газа увеличивается от значения V1=1,00 л до V2= 10,0 л. Определить приращение температуры DT газа. Для кислорода постоянная Ван-дер-Ваальса а = 0,136 Па×м6/моль2.
Решение. Расширяясь в пустоту, газ работы не совершает (А = 0). При адиабатическом процессе Q = 0. Поэтому согласно первому началу термодинамики DU = 0. Внутренняя энергия моля ван-дер-ваальсовского газа с двухатомными жесткими молекулами определяется выражением
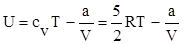
Приравняв значения этого выражения для начального и конечного состояний газа, получим, что

откуда
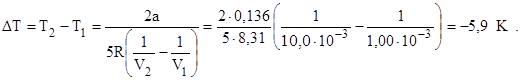
Газ охладили на 5,9 К.