Якщо зовнішнього електричного поля немає, то іони в електроліті перебувають в хаотичному тепловому русі. Оскільки всі напрями теплового руху рівно ймовірні, то переважаючого напряму перенесення іонів немає, тобто струму не буде. За наявності зовнішнього електричного поля на іони діє сила 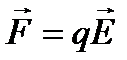 і вони набувають додаткової швидкості. Зауважимо, що рухаються не самі іони, а сольвати — іони, оточені полярними нейтральними молекулами розчинника, тобто рухаються цілі комплекси. Позитивні іони набувають додаткової швидкості в напрямі напруженості електричного поля, а негативні — у протилежному напрямі. Напрямлений рух позитивних і негативних іонів під дією зовнішнього електричного поля створює електричний струм. Густина струму
і вони набувають додаткової швидкості. Зауважимо, що рухаються не самі іони, а сольвати — іони, оточені полярними нейтральними молекулами розчинника, тобто рухаються цілі комплекси. Позитивні іони набувають додаткової швидкості в напрямі напруженості електричного поля, а негативні — у протилежному напрямі. Напрямлений рух позитивних і негативних іонів під дією зовнішнього електричного поля створює електричний струм. Густина струму 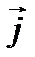 в електроліті складається з густини струму
в електроліті складається з густини струму 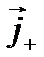 , зумовленої напрямленим рухом позитивних іонів, та густини струму
, зумовленої напрямленим рухом позитивних іонів, та густини струму 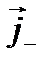 рухомих негативних іонів, тобто
рухомих негативних іонів, тобто
 . (10.10)
. (10.10)
Для спрощення розгляду явища провідності електролітів вважатимемо, що концентрація позитивних іонів п+ дорівнює концентрації негативних іонів п_,тобто n+ = п_ = п. Тоді заряд q+ позитивного іона дорівнює зарядові q- негативного іона, тобто q+=q_=q. Оскільки в електролітах, як і в металах, концентрація носіїв заряду не залежить від наявності зовнішнього електричного поля, а сумарний заряд позитивних і негативних зарядів у будь-якому об'ємі електроліту дорівнює нулеві, то можна записати
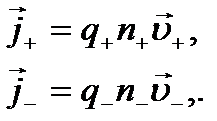 (10.11)
(10.11)
де v+ і v_ — швидкості впорядкованого руху під дією зовнішнього поля відповідно позитивних і негативних іонів (сольватів).
При впорядкованому русі іони в електролітах зазнають численних співударів з іншими молекулами. На них діють в'язкі сили тертя, які мають те саме походження, що й при русі макроскопічних тіл у рідинах або газах. З механіки відомо, що в'язкі сили тертя, яких зазнають тіла під час руху в рідинах або газах, при малій швидкості руху пропорційні швидкості. Тому на позитивні і негативні іони при їхньому напрямленому русі діятимуть відповідно в'язкі сили тертя 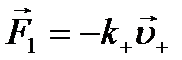 і
і 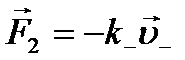 ( k+, k_ — коефіцієнти тертя для позитивних і негативних іонів). Тоді рівняння динаміки для напрямленого руху іонів матимуть вигляд
( k+, k_ — коефіцієнти тертя для позитивних і негативних іонів). Тоді рівняння динаміки для напрямленого руху іонів матимуть вигляд
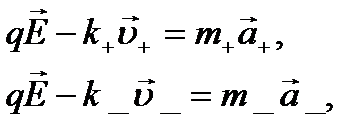 , (10.12)
, (10.12)
де а+, а_ — прискорення відповідно позитивних і негативних іонів.
Досліди показують, що за відсутності поляризації електродів (мала густина струму) сила струму під час електролізу не змінюється. Це свідчить про те, що при певних швидкостях напрямленого руху іонів сила тертя зрівноважується силою дії електричного поля, тобто прискорення іонів дорівнюють нулеві (a+ = а_ = 0). Тоді з рівнянь (10.12) одержимо:
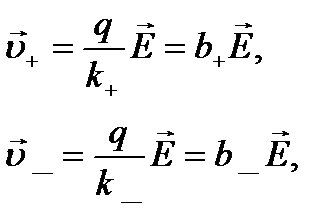 (10.13)
(10.13)
де величини b+ = q/k+ і b_ = q/k_ називають рухливостями позитивних і негативних іонів. З рівнянь (10.13) видно, що рухливість іона чисельно дорівнює швидкості його напрямленого руху при напруженості електричного поля Е = 1 В/м. На основі формул (10.11) і (10.13) вираз (10.10) набуває вигляду
 . (10.14)
. (10.14)
Якщо коефіцієнт дисоціації α, то п = αn0 (n0 — концентрація розчиненої речовини) і вираз (10.14) перепишеться так:
 . (10.15)
. (10.15)
Формула (10.15) виражає закон Ома в диференціальній формі для електролітів. Питома електропровідність електроліту
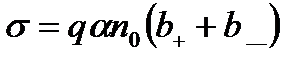 . (10.16)
. (10.16)
Введемо поняття еквівалентної концентрації η, під якою розуміють величину, що дорівнює кількості молів розчиненої речовини, яка припадає на одиницю об'єму (1 м3) розчину. Оскільки n0 — кількість молекул розчиненої речовини в одиниці об'єму, а N А — кількість молекул у молі, то η= n0 / N А . Запишемо добуток qn0 через N А :
 .
.
Оскільки qN А = F, а n0 / N А =η, то формула (10.16) набуває вигляду
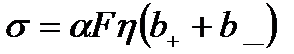 . (10.17)
. (10.17)
Відношення питомої електропровідності σ до еквівалентної концентрації розчиненої речовини називають еквівалентною електропровідністю:
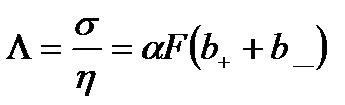 . (10.18)
. (10.18)
Для нескінченно розбавленого розчину ( 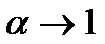 ) еквівалентна електропровідність
) еквівалентна електропровідність
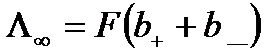 . (10.19)
. (10.19)
Тоді з (10.18) і (10.19) маємо
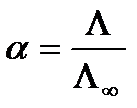 . (10.20)
. (10.20)
Вимірюючи еквівалентну електропровідність за формулою (10.20), можна обчислити коефіцієнт дисоціації. За формулою (10.18) або (10.19) знаходять суму рухливостей іонів (b+ + b_).
При невеликих концентраціях розчинів коефіцієнт дисоціації є величиною постійною. Сума рухливостей b+ + b_ за цієї умови також залишається величиною приблизно постійною. Отже, при малій концентрації розчину електропровідність пропорційна концентрації.
Концентраційна залежність електропровідності при великих концентраціях розчину значно ускладнюється. Тут треба враховувати залежність коефіцієнта дисоціації, а також рухливості іонів від концентрації. У концентрованих розчинах рухливість іонів зменшується внаслідок електричної взаємодії іонів один з одним. Тому при значних концентраціях розчину прямої пропорційності між електропровідністю і концентрацією розчину не спостерігається. З підвищенням температури коефіцієнт дисоціації збільшується, оскільки більш інтенсивний рух молекул перешкоджає процесу молізації і полегшує дисоціацію молекул. Під час нагрівання розчину його в'язкість зменшується, внаслідок чого рухливість іонів збільшується. Тому питома провідність електролітів з підвищенням температури зростає.
При високих напруженостях електричного поля (  106 В/м) спостерігається відхилення від закону Ома і залежність
106 В/м) спостерігається відхилення від закону Ома і залежність  має нелінійний характер.
має нелінійний характер.

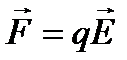 і вони набувають додаткової швидкості. Зауважимо, що рухаються не самі іони, а сольвати — іони, оточені полярними нейтральними молекулами розчинника, тобто рухаються цілі комплекси. Позитивні іони набувають додаткової швидкості в напрямі напруженості електричного поля, а негативні — у протилежному напрямі. Напрямлений рух позитивних і негативних іонів під дією зовнішнього електричного поля створює електричний струм. Густина струму
і вони набувають додаткової швидкості. Зауважимо, що рухаються не самі іони, а сольвати — іони, оточені полярними нейтральними молекулами розчинника, тобто рухаються цілі комплекси. Позитивні іони набувають додаткової швидкості в напрямі напруженості електричного поля, а негативні — у протилежному напрямі. Напрямлений рух позитивних і негативних іонів під дією зовнішнього електричного поля створює електричний струм. Густина струму 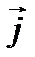 в електроліті складається з густини струму
в електроліті складається з густини струму 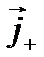 , зумовленої напрямленим рухом позитивних іонів, та густини струму
, зумовленої напрямленим рухом позитивних іонів, та густини струму 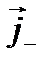 рухомих негативних іонів, тобто
рухомих негативних іонів, тобто . (10.10)
. (10.10)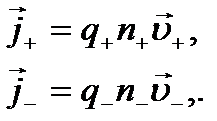 (10.11)
(10.11)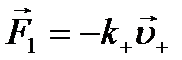 і
і 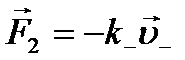 ( k+, k_ — коефіцієнти тертя для позитивних і негативних іонів). Тоді рівняння динаміки для напрямленого руху іонів матимуть вигляд
( k+, k_ — коефіцієнти тертя для позитивних і негативних іонів). Тоді рівняння динаміки для напрямленого руху іонів матимуть вигляд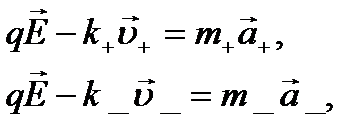 , (10.12)
, (10.12)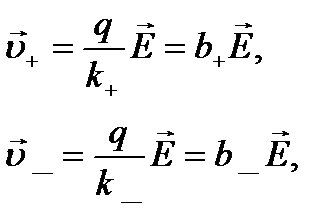 (10.13)
(10.13) . (10.14)
. (10.14) . (10.15)
. (10.15)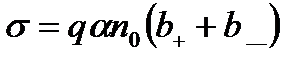 . (10.16)
. (10.16) .
.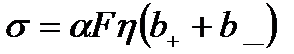 . (10.17)
. (10.17)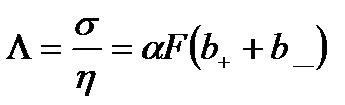 . (10.18)
. (10.18)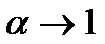 ) еквівалентна електропровідність
) еквівалентна електропровідність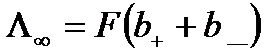 . (10.19)
. (10.19)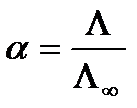 . (10.20)
. (10.20) 106 В/м) спостерігається відхилення від закону Ома і залежність
106 В/м) спостерігається відхилення від закону Ома і залежність  має нелінійний характер.
має нелінійний характер.