Згідно другого закону термодинаміки, ентропія визначається як відношення кількості теплоти до температури:
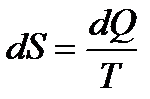 ,
,
тобто з точністю до постійного доданку, який не залежить від температури T, але може бути різним для різних тіл в стані рівноваги. Відповідні невизначені складові існують і для термодинамічних потенціалів.
1906 рік, німецький вчений Нернст на основі електротехнічних дослідів прийшов висновку, що ці доданки – універсальні і не залежать від тиску, об’єму, агрегатного стану та інших характеристик речовини. Цей новий принцип, який витікає з цих дослідів – третій закон термодинаміки, або закон Нернста.
В 1911 році Планк показав, що зміст теорії Нернста зводиться до:
1. при наближенні до абсолютного нуля, ентропія прямує до визначеної кінцевої границі. І тому є зміст казати про ентропію тіла 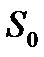 при абсолютному нулі температур;
при абсолютному нулі температур;
2. усі процеси при абсолютному нулі температур, які переводять систему з одного рівновісного в інший рівновісний стан, відбуваються без зміни ентропії.
Об’єднавши ці дві частини, маємо формулювання теореми Нернста: при наближенні до абсолютного нуля температур, приріст ентропії  визначається як:
визначається як:
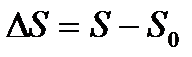
і прямує до визначеної кінцевої границі, що не залежить від значень, які приймають усі параметри, що характеризують стан системи .
Так як в термодинаміці ентропія може бути визначена з точності до довільної адитивної сталої, яка не залежить від параметрів системи, то сталу 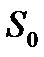 можна прийняти рівною нулю, тоді ентропію будь-якої рівновісної системи при абсолютному нулі температур можна вважати рівною нулю і тоді теорема Нернста може бути сформульована: при наближенні до абсолютного нуля, ентропія системи прямує до нуля, незалежно від того, які значення приймають усі параметри, що характеризують стан системи:
можна прийняти рівною нулю, тоді ентропію будь-якої рівновісної системи при абсолютному нулі температур можна вважати рівною нулю і тоді теорема Нернста може бути сформульована: при наближенні до абсолютного нуля, ентропія системи прямує до нуля, незалежно від того, які значення приймають усі параметри, що характеризують стан системи:
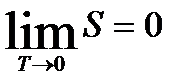 . (22)
. (22)
Таким чином, відповідно до третього закону термодинаміки, ентропія системи в рівновісному стані при температурі Т може бути розрахована за допомогою рівняння:
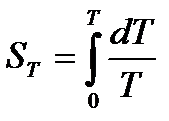 . (23)
. (23)
З третього закону термодинаміки випливає, що абсолютний нуль температур не можна досягнути ні в якому кінцевому процесі, що пов’язаний зі зміною ентропії. До нього можна лише асимптотично наближуватись.
Теорема Нернста не може бути пояснена з точки зору класичної фізики. Розглянемо приклад, пов’язаний з теплоємністю при постійному тиску (p=const), тоді:
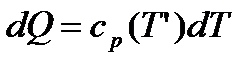 .
.
Теорема Нернста потребує виконання нерівності:
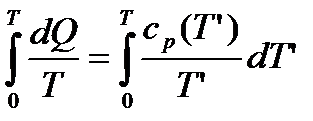 .
.
Сходимість даного інтеграла можлива лише при умові, що температура дорівнює нулеві. Теплоємність 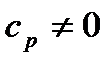 , що протирічить висновкам класичної фізики. Аналогічно веде себе теплоємність
, що протирічить висновкам класичної фізики. Аналогічно веде себе теплоємність 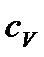 .
.

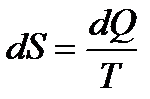 ,
,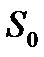 при абсолютному нулі температур;
при абсолютному нулі температур; визначається як:
визначається як: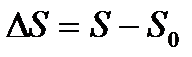
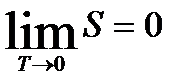 . (22)
. (22)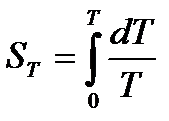 . (23)
. (23)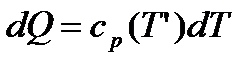 .
.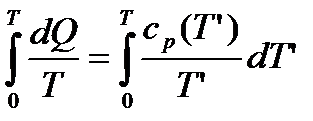 .
.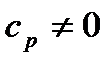 , що протирічить висновкам класичної фізики. Аналогічно веде себе теплоємність
, що протирічить висновкам класичної фізики. Аналогічно веде себе теплоємність 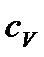 .
.