Лекція 5
2.1. Кристали та їх властивості
2.1.1. Будова кристалу
Більшість твердих тіл в природі мають кристалічну будову.
Характерна риса кристалічного стану, що відрізняє його від рідкого і газоподібного стану є наявність анізотропії – залежності ряду фізичних властивостей (механічних, теплових, електричних, оптичних) від напряму.
Тіла, властивості яких однакові у всіх напрямках, називаються ізотропними. Ізотропи, окрім газів і, за окремими виключеннями, всіх рідин, також аморфні тверді тіла (які представляють собою переохолоджені рідини).
Причиною анізотропії кристалів служить впорядковане розташування частинок (атомів чи молекул), з яких вони складаються. Впорядковане розташування частинок проявляється у правильній зовнішній огранці кристалів. Кристали обмежені плоскими гранями, що перетинаються під деякими, визначеними для кожного даного роду кристалів, кутами. Розколювання кристалів може легше відбуватися по визначеним площинам, що називаються площинами спайності.
Правильність геометричної форми і анізотропія кристалів зазвичай не проявляються, оскільки кристалічні тіла зустрічаються, як правило у вигляді полікристалів – конгломератів багатьох, зрісшихся між собою хаотично орієнтованих дрібних кристалів. В полікристалах анізотропія спостерігається лише в межах кожного окремо взятого кристала, тіло ж вцілому внаслідок хаотичної орієнтації кристалів, анізотропію не виявляє.
Створивши спеціальні умови кристалізації з розплаву чи розчину, можна отримати великі одиночні кристали – монокристали будь-якої речовини.
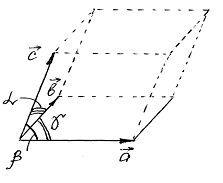
Рис. 1