§10. Електричний струм у рідинах
10.1. Електроліти. Електролітична дисоціація
 За хімічним складом розрізняють однокомпонентні, або чисті, рідини і дво- або багатокомпонентні рідкі суміші (розчини). За електричною провідністю речовини в рідкому стані поділяють на провідники (рідкі метали, деякі напівметали і напівпровідники, після плавлення вони мають електронну провідність); напівпровідники (після плавлення окремі напівпровідники зберігають характерні властивості напівпровідників: мають електронну або діркову провідність, чутливі до освітлення та зміни температури); діелектрики (рухомими носіями заряду в них можуть бути електрони та іони, але їх концентрація є надзвичайно малою й зумовлена домішками). Чисті рідини в переважній більшості є діелектриками (продукти перероблення нафти, спирти тощо). Зумовлено це тим, що чисті рідини складаються з нейтральних атомів або молекул, їхні заряди зв'язані в атомах і, отже, не можуть брати участі у створенні струму.
За хімічним складом розрізняють однокомпонентні, або чисті, рідини і дво- або багатокомпонентні рідкі суміші (розчини). За електричною провідністю речовини в рідкому стані поділяють на провідники (рідкі метали, деякі напівметали і напівпровідники, після плавлення вони мають електронну провідність); напівпровідники (після плавлення окремі напівпровідники зберігають характерні властивості напівпровідників: мають електронну або діркову провідність, чутливі до освітлення та зміни температури); діелектрики (рухомими носіями заряду в них можуть бути електрони та іони, але їх концентрація є надзвичайно малою й зумовлена домішками). Чисті рідини в переважній більшості є діелектриками (продукти перероблення нафти, спирти тощо). Зумовлено це тим, що чисті рідини складаються з нейтральних атомів або молекул, їхні заряди зв'язані в атомах і, отже, не можуть брати участі у створенні струму.
Рис. 10.1
Серед дво- або багатокомпонентних рідких сумішей виділяють електроліти. У широкому розумінні слова це речовини, які мають іонний механізм провідності, їх часто називають провідниками другого роду. Найбільш типовими представниками електролітів є водні розчини неорганічних кислот (НС1, Н25О4, НМО3), лугів (КаОН, КОН, Са(ОН)2), солей (КаСІ, А^63, СІІ5О4). Замість води розчинниками можуть бути спирти або неорганічні рідини (гексан, діоксан, бензол тощо). Такі розчини солей, кислот, лугів також мають іонну провідність, але їхня електропровідність значно менша від електропровідності водних електролітів. Зазначимо, що не всі водні розчини речовин є електролітами. Наприклад, розчин цукру у воді не є електролітом і не проводить електрики.
Впорядкований рух іонів (струм) в електролітах відбувається під дією електричного поля, яке створюється джерелом струму, під’єднаним до електродів, опущених в електроліт.
Які процеси зумовлюють утворення в електролітах носіїв заряду (іонів)? Сучасна фізична теорія провідності електролітів пояснює це тим, що молекули розчиненої речовини розпадаються в розчиннику на складові частини, які під час розчинення набувають різнойменних зарядів, тобто стають позитивними і негативними іонами. Явище розпаду речовини на різнойменне заряджені іони під дією розчинника називають електролітичною дисоціацією.
Процес розпадання молекул на окремі іони можна уявити так. Навколо кожного з іонів розчиненої речовини, наприклад NaС1, орієнтуються полярні молекули розчинника (води). Позитивно заряджені іони натрію притягують негативні полюси дипольних молекул води. При цьому вони відштовхують негативні іони хлору. Аналогічна картина матиме місце для іонів хлору (рис. 10.1). Процес взаємодії іонів з дипольними молекулами розчинника називають сольватацією. Такий процес послаблює зв’язки між іонами натрію і хлору. Внаслідок теплового руху молекул можливі й розриви цих зв’язків і утворення іонів натрію та хлору. З наступним збільшенням відстані між іонами сила кулонівської взаємодії зменшується в ε разів (ε — діелектрична проникність розчинника). Частинки розчиненої речовини взаємодіють з молекулами розчинника, утворюючи комплекси — сольвати (для водних розчинів — гідрати).
При зближенні позитивного і негативного іонів вони можуть з’єднатись (рекомбінувати) і утворити нейтральну молекулу. Інші нейтральні молекули, навпаки, можуть дисоціювати на іони. Внаслідок цього встановлюється динамічна рівновага процесів дисоціації і рекомбінації, при якій статистичне частка дисоційованих молекул у середньому залишається незмінною в часі. Творцем теорії електролітичної дисоціації є шведський фізико-хімік С. Арреніус (1859 — 1927).
Під час створення електричного поля введенням в електроліт металевих електродів, приєднаних до позитивного і негативного полюсів джерела струму, відбувається переміщення позитивних іонів (катіонів) до катода, а негативних іонів (аніонів) у протилежному напрямі — до анода. Виникає електричний струм. При цьому відбувається розділення і виділення утворених іонів (продуктів розпаду розчиненої речовини) на електродах. Це явище називають електролізом.
Як зазначалося, здатність молекул розчиненої речовини дисоціювати у різних розчинниках неоднакова. Для кількісної характеристики дисоціації вводять коефіцієнт дисоціації α, який визначається відношенням кількості дисоційованих молекул розчиненої речовини до повної їх кількості. Припустимо, що в одиниці об’єму розчину перебуває n0 молекул розчиненої речовини, з яких п дисоціювали. Коефіцієнт дисоціації
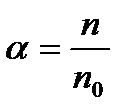 . (10.1)
. (10.1)
Для 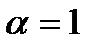 дисоціація буде повною, а при α = 0 її взагалі не буде. Якщо
дисоціація буде повною, а при α = 0 її взагалі не буде. Якщо 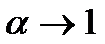 , то такі електроліти називають сильними, а при
, то такі електроліти називають сильними, а при 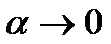 — слабкими. Теорію сильних електролітів розробили німецькі вчені П. Дебай (1884 - 1966) і Е. Хюккель (1896 - 1980).
— слабкими. Теорію сильних електролітів розробили німецькі вчені П. Дебай (1884 - 1966) і Е. Хюккель (1896 - 1980).
Залежно від кількості різних іонів, що утворюються в розчині, електроліти називають бінарними (КС1, NaОН, НN3), тернарними (СаС12, Н2SО4, SrСl2) і т. д. Для спрощення будемо розглядати бінарні електроліти. У загальному випадку в одиниці об'єму не дисоцінованих молекул буде 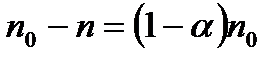 . Очевидно, кількість молекул, які дисоціюють за одиницю часу в одиниці об'єму
. Очевидно, кількість молекул, які дисоціюють за одиницю часу в одиниці об'єму 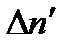 , пропорційна кількості не дисоційованих молекул, тобто
, пропорційна кількості не дисоційованих молекул, тобто
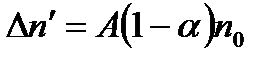 ,
,
де А — коефіцієнт пропорційності, який залежить від природи електроліту і його температури.
Кількість актів рекомбінації 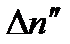 в одиниці об'єму за одиницю часу пропорційне як кількості позитивних
в одиниці об'єму за одиницю часу пропорційне як кількості позитивних 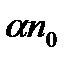 , так і негативних
, так і негативних 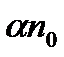 іонів, що містяться в одиниці об'єму бінарного електроліту, тобто
іонів, що містяться в одиниці об'єму бінарного електроліту, тобто
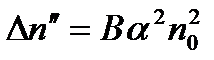 ,
,
де В — коефіцієнт пропорційності. У стані динамічної рівноваги між обома процесами 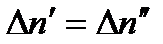 , або
, або
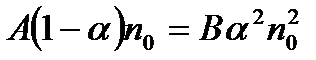 . (10.2)
. (10.2)
Звідси маємо
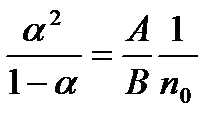 . (10.3)
. (10.3)
Формула (10.3) виражає закон розведення Освальда. Відношення А/В називають константою рівноваги або константою дисоціації. Із закону Освальда випливає, що для досить розведених розчинів ( 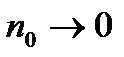 ) коефіцієнт дисоціації
) коефіцієнт дисоціації 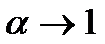 , тобто всі молекули розчиненої речовини дисоціюють. Закон розведення Освальда добре виконується для слабких електролітів, тобто таких, для яких ступінь дисоціації є малим. Для сильних електролітів (майже всі молекули розчинника дисоціюють) закон Освальда для концентрованих розчинів погано узгоджується з дослідними результатами, за винятком сильно розбавлених розчинів, для яких дійсно
, тобто всі молекули розчиненої речовини дисоціюють. Закон розведення Освальда добре виконується для слабких електролітів, тобто таких, для яких ступінь дисоціації є малим. Для сильних електролітів (майже всі молекули розчинника дисоціюють) закон Освальда для концентрованих розчинів погано узгоджується з дослідними результатами, за винятком сильно розбавлених розчинів, для яких дійсно 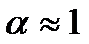 . За сучасною теорією розчинів вважають, що для сильних електролітів у дійсності всі молекули розчинника дисоційовані, а відхилення від закону Освальда пояснюються взаємодією іонів між собою та з молекулами розчинника.
. За сучасною теорією розчинів вважають, що для сильних електролітів у дійсності всі молекули розчинника дисоційовані, а відхилення від закону Освальда пояснюються взаємодією іонів між собою та з молекулами розчинника.

 За хімічним складом розрізняють однокомпонентні, або чисті, рідини і дво- або багатокомпонентні рідкі суміші (розчини). За електричною провідністю речовини в рідкому стані поділяють на провідники (рідкі метали, деякі напівметали і напівпровідники, після плавлення вони мають електронну провідність); напівпровідники (після плавлення окремі напівпровідники зберігають характерні властивості напівпровідників: мають електронну або діркову провідність, чутливі до освітлення та зміни температури); діелектрики (рухомими носіями заряду в них можуть бути електрони та іони, але їх концентрація є надзвичайно малою й зумовлена домішками). Чисті рідини в переважній більшості є діелектриками (продукти перероблення нафти, спирти тощо). Зумовлено це тим, що чисті рідини складаються з нейтральних атомів або молекул, їхні заряди зв'язані в атомах і, отже, не можуть брати участі у створенні струму.
За хімічним складом розрізняють однокомпонентні, або чисті, рідини і дво- або багатокомпонентні рідкі суміші (розчини). За електричною провідністю речовини в рідкому стані поділяють на провідники (рідкі метали, деякі напівметали і напівпровідники, після плавлення вони мають електронну провідність); напівпровідники (після плавлення окремі напівпровідники зберігають характерні властивості напівпровідників: мають електронну або діркову провідність, чутливі до освітлення та зміни температури); діелектрики (рухомими носіями заряду в них можуть бути електрони та іони, але їх концентрація є надзвичайно малою й зумовлена домішками). Чисті рідини в переважній більшості є діелектриками (продукти перероблення нафти, спирти тощо). Зумовлено це тим, що чисті рідини складаються з нейтральних атомів або молекул, їхні заряди зв'язані в атомах і, отже, не можуть брати участі у створенні струму.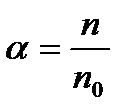 . (10.1)
. (10.1)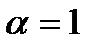 дисоціація буде повною, а при α = 0 її взагалі не буде. Якщо
дисоціація буде повною, а при α = 0 її взагалі не буде. Якщо 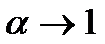 , то такі електроліти називають сильними, а при
, то такі електроліти називають сильними, а при 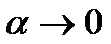 — слабкими. Теорію сильних електролітів розробили німецькі вчені П. Дебай (1884 - 1966) і Е. Хюккель (1896 - 1980).
— слабкими. Теорію сильних електролітів розробили німецькі вчені П. Дебай (1884 - 1966) і Е. Хюккель (1896 - 1980).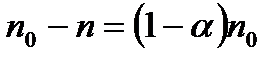 . Очевидно, кількість молекул, які дисоціюють за одиницю часу в одиниці об'єму
. Очевидно, кількість молекул, які дисоціюють за одиницю часу в одиниці об'єму 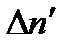 , пропорційна кількості не дисоційованих молекул, тобто
, пропорційна кількості не дисоційованих молекул, тобто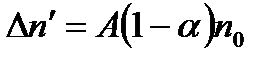 ,
,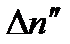 в одиниці об'єму за одиницю часу пропорційне як кількості позитивних
в одиниці об'єму за одиницю часу пропорційне як кількості позитивних 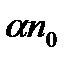 , так і негативних
, так і негативних 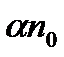 іонів, що містяться в одиниці об'єму бінарного електроліту, тобто
іонів, що містяться в одиниці об'єму бінарного електроліту, тобто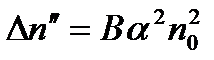 ,
,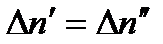 , або
, або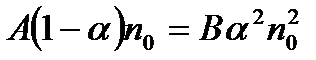 . (10.2)
. (10.2)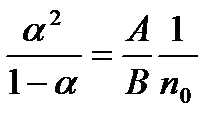 . (10.3)
. (10.3)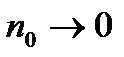 ) коефіцієнт дисоціації
) коефіцієнт дисоціації 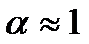 . За сучасною теорією розчинів вважають, що для сильних електролітів у дійсності всі молекули розчинника дисоційовані, а відхилення від закону Освальда пояснюються взаємодією іонів між собою та з молекулами розчинника.
. За сучасною теорією розчинів вважають, що для сильних електролітів у дійсності всі молекули розчинника дисоційовані, а відхилення від закону Освальда пояснюються взаємодією іонів між собою та з молекулами розчинника.