Характеристики ідеального газу:
1. концентрація молекул приблизно 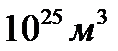 ;
;
2. середня відстань між молекулами 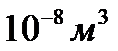 ;
;
3. сумарний власний об’єм молекули, що знаходяться в 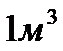 газу складає
газу складає 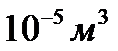 (даним об’ємом можна знехтувати).
(даним об’ємом можна знехтувати).
На основі експериментів з такими газами було встановлено ряд закономірностей, які виконувались для ідеальних газів обов’язково, а для реальних газів можуть бути виконані лише при певних умовах (не дуже високих температурах і відносно низькому тиску, простій структурі, малих розмірах і низькій концентрації).
Закон Бойля-Маріотта (1662р.).
При постійній температурі об’єм даної маси газу обернено пропорційний його тиску:
 , (1)
, (1)
c – постійна величина, пропорційна кількості молів газу і його абсолютній температурі.
Закон Гей-Люссака (1802р.).
Об’єм даної маси газу при постійному тиску змінюється лінійно з температурою:
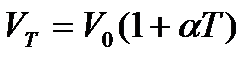 , (2)
, (2)
 ,
, 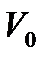 - об’єми газу при температурі T і 0
- об’єми газу при температурі T і 0  ;
;
 - термічний коефіцієнт розширення при постійному тиску.
- термічний коефіцієнт розширення при постійному тиску.
Для всіх газів при нормальних умовах:
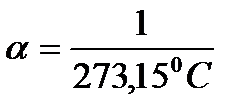 . (3)
. (3)
За абсолютною шкалою температур:
 . (4)
. (4)
Закон Шарля (1787р.).
Тиск даної маси газу при постійному об’ємі змінюється лінійно з температурою:
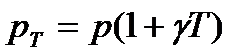 , (5)
, (5)
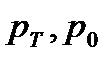 - тиски газу при температурі Т і 0
- тиски газу при температурі Т і 0 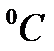 ;
;
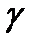 - термічний коефіцієнт тиску при постійному об’ємі.
- термічний коефіцієнт тиску при постійному об’ємі.
Для всіх газів при нормальних умовах 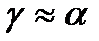 .
.
За абсолютною шкалою температур:
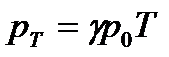 . (6)
. (6)
Закон Авогадро.
Гей-Люссак сформулював закон з’єднаних об’ємів для газів: об’єм газів, що реагують або що утворюються у результаті хімічних реакцій, знаходяться у відношеннях невеликих цілих чисел. Авогадро висунув гіпотезу, що в рівних об’ємах різних газів при однаковій температурі і тиску знаходиться однакове число молекул.
Один моль будь-якого газу, який є подібним до ідеального газу при однаковій температурі і тиску, займає однаковий об’єм.
При нормальних умовах даний об’єм:
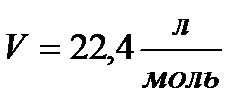 .
.

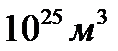 ;
;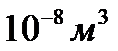 ;
;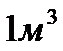 газу складає
газу складає 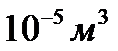 (даним об’ємом можна знехтувати).
(даним об’ємом можна знехтувати). , (1)
, (1)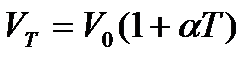 , (2)
, (2) ,
,  - об’єми газу при температурі T і 0
- об’єми газу при температурі T і 0  ;
; - термічний коефіцієнт розширення при постійному тиску.
- термічний коефіцієнт розширення при постійному тиску.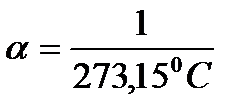 . (3)
. (3) . (4)
. (4)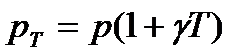 , (5)
, (5)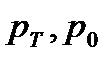 - тиски газу при температурі Т і 0
- тиски газу при температурі Т і 0  ;
;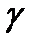 - термічний коефіцієнт тиску при постійному об’ємі.
- термічний коефіцієнт тиску при постійному об’ємі.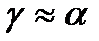 .
.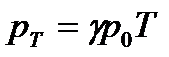 . (6)
. (6)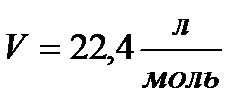 .
.