Всі речовини при сильному нагріванні починають світитися. Світіння нагрітих тіл називають тепловим рівноважним випромінюванням. Але деякі речовини світяться без нагрівання - при кімнатній температурі. Таке випромінювання називають люмінесценцією. На відміну від теплового випромінювання люмінесценція є нерівноважним випромінюванням.
Найбільш вдалим визначенням люмінесценції, яке характеризує суть явища, є визначення В.Л. Левшина:
Люмінесценція — це світіння атомів, молекул, іонів та інших більш складних комплексів, яке виникає в результаті електронного переходу в цих частинках, при їх повертанні зі збудженого стану в нормальний.
Речовини, які здатні люмінесціювати, називають люмінофорами.
l Неорганічні люмінофори називають просто люмінофорами.
l Органічні люмінофори називають органолюмінофорами.
l Складні неорганічні кристалічні люмінофори з дефектною структурою, яка визвана втіленням в їх кристалічну гратку іонів важких металів (активаторів) називають кристалофосфорами.
Датою народження люмінесцентного методу аналізу є 4 березня 1864 року, коли відомий англійський фізик Стокс зробив доповідь у Королівському товаристві і звернув увагу на можливість використання люмінесценції для аналізу органічних сполук.
В розробку теорії люмінесценції великий внесок зробив радянський вчений С.І.Вавілов.

Бібліографічна довідка:
Серге́й Ива́нович Вави́лов (12 (24) марта 1891, Москва — 25 января 1951, Москва) — советский физик, основатель научной школы физической оптики в СССР, академик (1932) и президент Академии наук СССР (с 1945), лауреат Сталинской премии. Младший брат Н. И. Вавилова, русского учёного-генетика.
Основным направлением в науке для Сергея Вавилова было исследование оптики, в частности явления люминесценции.
Великий внесок в розвиток хемілюмінесцентного аналізу зробив Анатолій Кирилович Бабко та співробітники його школи.
Бібліографічна довідка:
Закінчив Київський політехнічний інститут, вважається учнем академіка Н.А.Тананаєва, доктор хімічних наук, професор Київського університета, академік АН УРСР.
Люмінесценція виникає в наслідок поглинання речовиною квантів hν0 електромагнітного випромінювання і збудження молекул або атомів. Молекула або атом речовини переходить в збуджений стан В і через деякий час (≈ 10-12 с) повертається в основний стан А, при цьому випромінює енергію у вигляді квантів. Частина енергії випромінюється спочатку у вигляді кванта теплової енергії.
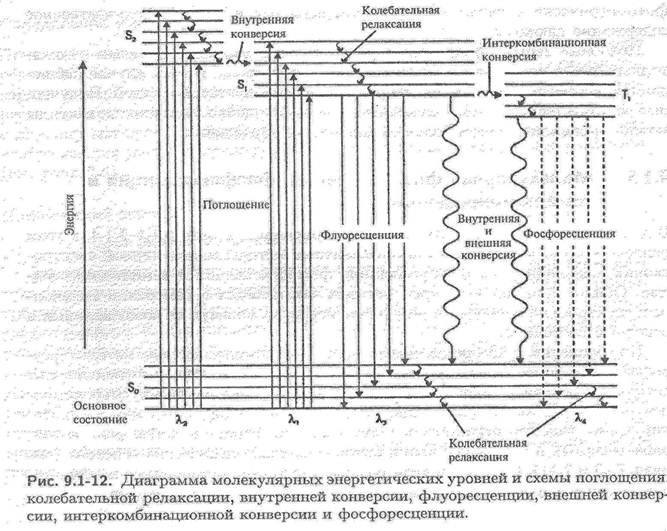


Розрізнюють основний синглетний (S0) та збуджені синглетний (Sn)та триплетний (Tn) електронні рівні молекули. На кожний електронний рівень накладаються коливальні підрівні з квантовими числами 0, 1, 2, 3 і т.д..
При поглинанні кванта світла електрон переходить з основного рівня на більш високий, який відповідає збудженим синглетному (антипаралельні спіни) і триплетному (паралельні спіни) станам.
Прямий перехід з основного синглетного в збуджений триплетний стан заборонений за спіном і практично не спостерігається.
Енергія триплетного стану дещо менше, ніж синглетного. Триплетні рівні можуть заповнюватися за рахунок інтеркомбінаційної конверсії S1 → T1 (хвиляста горизонтальна стрілка).
Стадія1.
При кімнатній температурі молекули звичайно знаходяться в основному стані і майже всі електронні переходи при поглинанні світла відбуваються з нижнього основного коливального підрівня на різні коливальні підрівні збудженого синглетного стану.
Стадія2
Збуджена молекула за рахунок коливальної релаксації при стиканні з оточуючими молекулами дуже швидко втрачає надлишкову коливальну енергію і переходить на основний коливальний рівень збудженого синглетного електронного стану.
Стадія3а.
Далі відбувається випромінювальний перехід з основного коливального рівня збудженого синглетного стану на будь-який коливальний підрівень основного синглетного стану: S1 → S0. – флуоресценція. Тривалість флуоресценції – τ(тау) - 10-8 – 10-7 с.
Стадія3б.
випромінювальний перехід між двома електронними станами різної мультиплетності: Т1 → S0, де Т1 – перший збуджений триплетний стан. Тривалість фосфоресценції – τ(тау) - 10-3 – 10 с (фосфоресценцію спостерігають при низьких температурах, зменшується ймовірність безвипромінювального переходу.)
Існують такі види класифікації люмінесценції:
Ø За зовнішнім джерелом збудження;
Ø За тривалістю світіння;
Ø За механізмом світіння.
Для збудження люмінесценції необхідно підводити енергію ззовні в зв'язку з тим, що вона втрачається при випромінюванні. Тому види люмінесценції класифікують за зовнішнім джерелом збудження енергії
| №п/п
| Джерело збудження
| Вид люмінесценції
|
|
| Електромагнітне випромінювання УФ та видимого спектрального діапазону
| Фотолюмінесценція
|
|
| Потік електронів
| Катодолюмінесценція
|
|
| Потік іонів лужних металів у вакуумі
| Іонолюмінесценція
|
|
| Рентгенівське випромінювання
| Рентгенолюмінесценція
|
|
| Радіоактивне випромінювання
| Радіолюмінесценція
|
|
| Теплова енергія
| Термолюмінесценція (або кандолюмінесценція)
|
|
| Ультразвук
| Сонолюмінесценція
|
|
| Механічна дія
| Триболюмінесценція
|
|
| Енергія хімічних реакцій
| Хемілюмінесценція
|
За тривалістю світіння люмінесценцію розділяють на флуоресценцію(короткотривала,10-8 – 10-7 с)тафосфоресценцію(довготривала,10-4 – 102 с),суть яких розглянемо пізніше.
За механізмом світіння розрізнюють:
Ø світіння дискретних центрів;
Ø рекомбінаційне світіння.
В першому випадку і поглинають, і випромінюють одні і ті ж частинки — атоми і молекули. Цей вид світіння характерний для речовин в газуватому стані, розчинам неорганічних і органічних речовин, чистим органічним розчинникам.
Рекомбінаційне світіння спостерігають у тих випадках, коли процеси поглинання та випромінювання розділені як в часі, так і у просторі. Тут в процесі збудження відбувається розподіл частинки речовини на 2 частини — іони і радикали. Наступна їх рекомбінація супроводжується виділенням енергії. Ця енергія переводить частинку в збуджений стан. Повертаючись в основний стан, частинка випромінює квант світла.
Рекомбінаційна люмінесценція характерна для кристалофосфорів та для деяких газів про рекомбінації іонів або радикалів.