2.4.1. Закон розподілу Больцмана
Розглянемо розподіл мікрочастинок за енергіями на прикладі ідеального газу, що знаходяться в полі тяжіння: нехай сили поля напрямлені вздовж осі z.
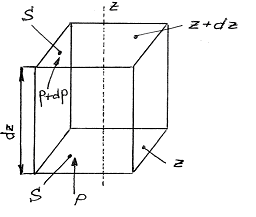
Рис. 1
Тиск газу в різних точках вздовж цієї осі буде різним. Виберемо дві площини 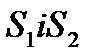 , причому
, причому 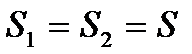 . Ці площини орієнтовані перпендикулярно до осі z і знаходяться на відстані dz одна від одної. Якщо тиск газу на обох площинах буде чисельно дорівнювати p i p+dp, то різниця тисків dp чисельно дорівнює сумарній силі, що діє на частинки газу, що знаходяться в об’ємі даного паралелепіпеда з основою S і висотою dz відносно до площі даної основи:
. Ці площини орієнтовані перпендикулярно до осі z і знаходяться на відстані dz одна від одної. Якщо тиск газу на обох площинах буде чисельно дорівнювати p i p+dp, то різниця тисків dp чисельно дорівнює сумарній силі, що діє на частинки газу, що знаходяться в об’ємі даного паралелепіпеда з основою S і висотою dz відносно до площі даної основи:
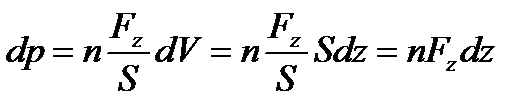 ,
,
n – концентрація молекул в даному об’ємі;
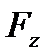 - сила, що діє на 1моль в точці з координатою z.
- сила, що діє на 1моль в точці з координатою z.
Дана сила пов’язана з потенціальною енергією молекули співвідношенням:
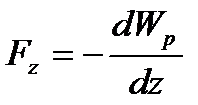 .
.
Таким чином, додатковий тиск dp чисельно дорівнює:
 .
.
Приймаючи температуру ідеального газу у всіх точках однаковою, на основі рівняння Менделєєва-Клайперона, знаходимо, що:
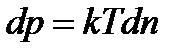 .
.
Співставляючи два останні рівняння:
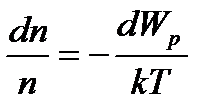 .
.
Проінтегрувавши і пропотенціювавши даний вираз, отримаємо:
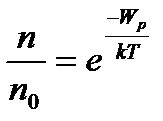
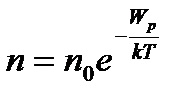 . (1)
. (1)
Рівняння (1) називають законом розподілу Больцмана.
В даному рівнянні 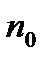 і n- концентрації молекул газу в стані з відповідно прийнятою нульовою потенціальною енергією і деякою
і n- концентрації молекул газу в стані з відповідно прийнятою нульовою потенціальною енергією і деякою 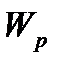 в стані 1.
в стані 1.
Рівняння може бути отримане з більш загальних міркувань. Воно має універсальний характер, бо використовується для будь-яких систем з мікрочастинок, що знаходяться в різних потенціальних полях. Наприклад, для поля тяжіння Землі на великій висоті:
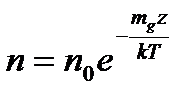 . (2)
. (2)
Для двох різних станів з потенціальними енергіями 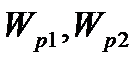 , отримаємо:
, отримаємо:
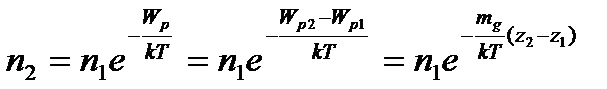 . (3)
. (3)
Так як тиск газу пов’язаний з концентрацією молекул рівнянням p=nkT, то на основі рівняння (2), запишемо:
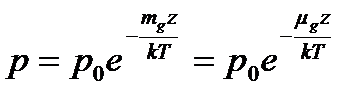 . (4)
. (4)
Тиск p і тиск 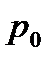 :
:
 - тиск на поверхні Землі;
- тиск на поверхні Землі;
p - на висоті z над Землею;
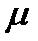 - молярна маса газу.
- молярна маса газу.
Рівняння (4) – барометрична формула.
2.4.2. Закон розподілу Максвела

Рис. 2
Теплова або середня квадратична швидкість 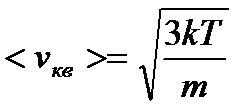 представляє собою середню характеристику теплового руху усієї сукупності мікрочастинок. В дійсності, всі мікрочастинки рухаються з різними швидкостями і можна поставити питання про розподіл мікрочастинок за швидкостями.
представляє собою середню характеристику теплового руху усієї сукупності мікрочастинок. В дійсності, всі мікрочастинки рухаються з різними швидкостями і можна поставити питання про розподіл мікрочастинок за швидкостями.
Максвел вирішив цю задачу про розподіл молекул ідеального газу за швидкостями постійного руху в стані теплової рівноваги. Він показав, що вірогідність того, що деяке число молекул dN із загального числа молекул N володіє швидкостями, що лежать у інтервалі від  до
до  . Виражається дана вірогідність відношенням:
. Виражається дана вірогідність відношенням:
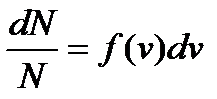 , (5)
, (5)
f(v) - функція розподілу молекул за швидкостями;
dv - інтервал швидкостей, що розглядається.
Вигляд функції можна встановити на прикладі руху молекул ідеального газу в однорідному полі тяжіння. Спочатку розглянемо закон розподілу молекул по значенням вертикальної складової швидкості. Число молекул , що знаходяться в безкінечно тонкому шарі газу на висоті z, товщина dz:
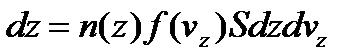 ,
,
n(z) – концентрація молекул газу на висоті z.
Рухаючись як вільні, дані молекули через деякий інтервал часу перейдуть на висоту 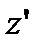 і займуть шар
і займуть шар 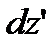 . При цьому, їх швидкості будуть лежати в інтегралі від
. При цьому, їх швидкості будуть лежати в інтегралі від 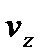 до
до 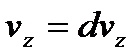 , але одне і те ж число молекул. Якщо прийняти, що
, але одне і те ж число молекул. Якщо прийняти, що 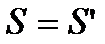 , то незмінність числа цих молекул виражається:
, то незмінність числа цих молекул виражається:
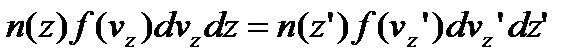 , (6)
, (6)
 - концентрація молекул газу на висоті
- концентрація молекул газу на висоті 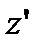 .
.
При русі в полі тяжіння горизонтальні складові швидкості 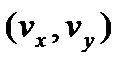 не будуть змінюватись, а зміна
не будуть змінюватись, а зміна 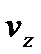 визначається законом збереження енергії, згідно якого:
визначається законом збереження енергії, згідно якого:
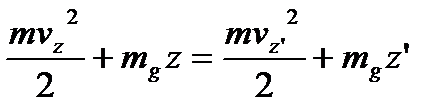 .
.
Якщо продиференціювати це рівняння, при вибраних сталих значеннях 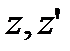 , отримаємо:
, отримаємо:
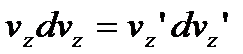 .
.
За час dt молекула на висоті z пройде шлях 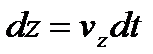 , а на висоті
, а на висоті 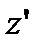 , пройде шлях
, пройде шлях 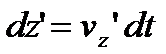 .
.
Якщо виключимо елементарний час dt, то:
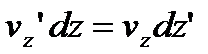 . (7)
. (7)
Перемножимо почленно рівняння (6) і (7) і знайдемо:
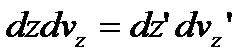 .
.
Із урахуванням останнього виразу, рівняння (5) спрощується і приймає вигляд:
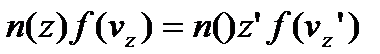 .
.
Використовуючи закон Больцмана у вигляді рівняння (2), отримаємо:
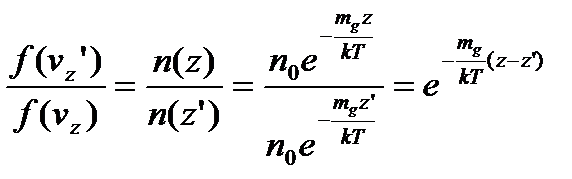 .
.
На основі закону збереження і перетворення енергії, знаходимо, що:
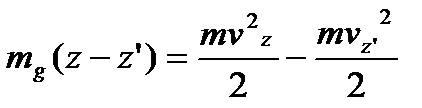 .
.
Тоді:
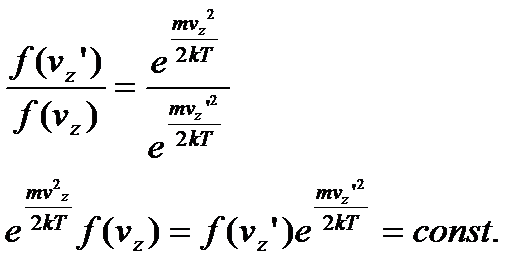
Звідси слідує, що:
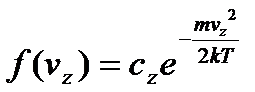 . (8)
. (8)
В стані теплової рівноваги рух молекул газу буде рівновигідним по всіх напрямках.
Так як вірогідність складної події, яка складається з незалежних подій, рівна добутку вірогідностей цих подій, то повні функція розподілу молекул за швидкостями буде мати вигляд:
 .
.
Тоді:

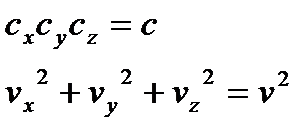
 . (9)
. (9)
З урахуванням рівняння (9), запишемо рівняння (5):
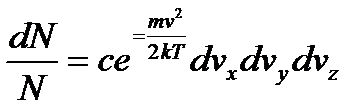 , (10)
, (10)
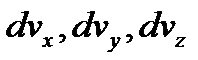 - об’єми нескінчено малого паралелепіпеда, що побудований в координатній системі простору швидкостей навколо точки з векторною координатою
- об’єми нескінчено малого паралелепіпеда, що побудований в координатній системі простору швидкостей навколо точки з векторною координатою  .
.
Так як тепловий рух молекул газу рівновірогідний у всіх напрямках, для визначення відношення 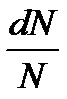 необхідно просумувати усі елементарні об’єми, що знаходяться на відстані
необхідно просумувати усі елементарні об’єми, що знаходяться на відстані  і ці об’єми заповнять шаровий прошарок між 2 нескінчено-близькими сферами з радіусами v i v+dv.
і ці об’єми заповнять шаровий прошарок між 2 нескінчено-близькими сферами з радіусами v i v+dv.
Об’єм такого шару:
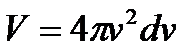 .
.
Таким чином, число молекул з швидкостями в інтервалі від v до v+dv буде чисельно дорівнювати:
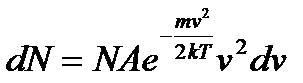 , (11)
, (11)
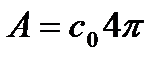 - деяка стала, що не залежить від швидкості молекул.
- деяка стала, що не залежить від швидкості молекул.
Знайдемо вираз величини А. Так як інтервал швидкостей від нуля до нескінченності охоплює всі молекули, то очевидно, що інтеграл:
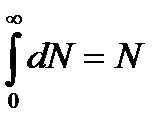 ,
,
тоді:
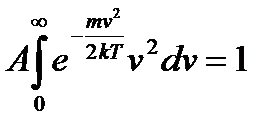 .
.
Якщо зробити заміну змінних 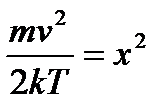 і скористатися значенням, що
і скористатися значенням, що 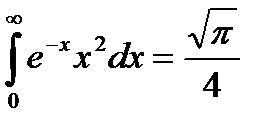 , то знайдемо:
, то знайдемо:
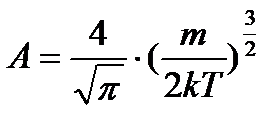 .
.
З урахуванням цього, закон розподілу Максвела:
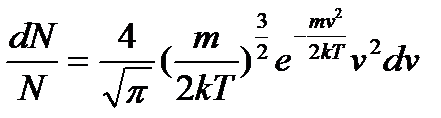 . (12)
. (12)
Графік функції рівняння (9) представляє собою Гаусову криву розподілу випадкової кривої:
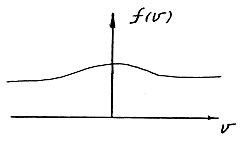
Рис. 3
Густина вірогідності розподілу молекул по швидкостям буде мати вигляд:
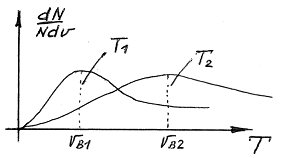
Рис. 4
Як слідує з даного рівняння, при кожній температурі є деяка швидкість, яка має найбільше число молекул (цю швидкість називають найбільш вірогідною). Знайдемо вираз для цієї швидкості з урахуванням рівняння (12), дослідивши дане рівняння на екстремуми. Скоротивши в рівнянні (12) сталі величини і проінтегрувавши, отримаємо:
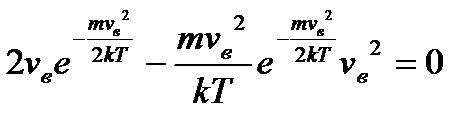 .
.
Звідси знаходимо вірогідну швидкість:
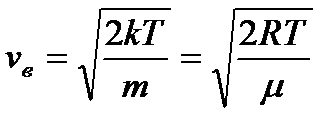 . (13)
. (13)
Середня арифметична швидкість молекул:
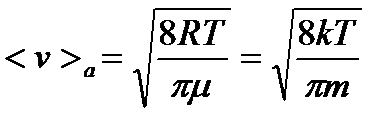 .
.
Стан газу можна характеризувати однією з трьох швидкостей:
- вірогідною;
- середньою арифметичною;
- середньою квадратичною.
Наприклад:
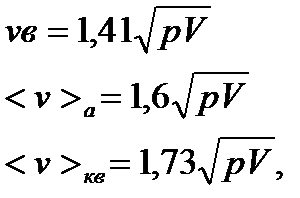
p,V – тиск і об’єм.
Співвідношення між цими швидкостями:
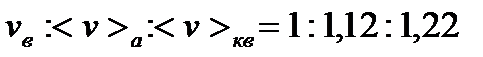 .
.


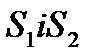 , причому
, причому 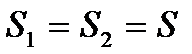 . Ці площини орієнтовані перпендикулярно до осі z і знаходяться на відстані dz одна від одної. Якщо тиск газу на обох площинах буде чисельно дорівнювати p i p+dp, то різниця тисків dp чисельно дорівнює сумарній силі, що діє на частинки газу, що знаходяться в об’ємі даного паралелепіпеда з основою S і висотою dz відносно до площі даної основи:
. Ці площини орієнтовані перпендикулярно до осі z і знаходяться на відстані dz одна від одної. Якщо тиск газу на обох площинах буде чисельно дорівнювати p i p+dp, то різниця тисків dp чисельно дорівнює сумарній силі, що діє на частинки газу, що знаходяться в об’ємі даного паралелепіпеда з основою S і висотою dz відносно до площі даної основи: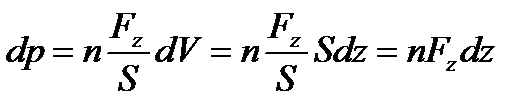 ,
,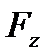 - сила, що діє на 1моль в точці з координатою z.
- сила, що діє на 1моль в точці з координатою z.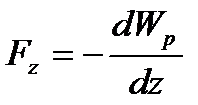 .
. .
.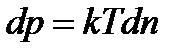 .
.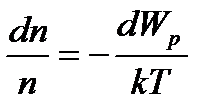 .
.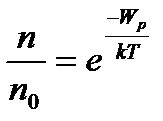
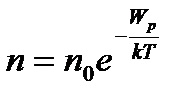 . (1)
. (1)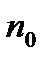 і n- концентрації молекул газу в стані з відповідно прийнятою нульовою потенціальною енергією і деякою
і n- концентрації молекул газу в стані з відповідно прийнятою нульовою потенціальною енергією і деякою 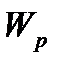 в стані 1.
в стані 1.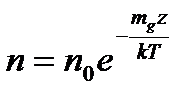 . (2)
. (2)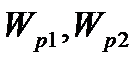 , отримаємо:
, отримаємо: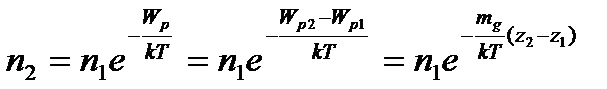 . (3)
. (3)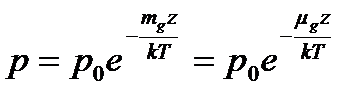 . (4)
. (4)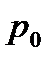 :
: - тиск на поверхні Землі;
- тиск на поверхні Землі;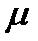 - молярна маса газу.
- молярна маса газу.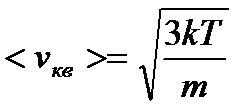 представляє собою середню характеристику теплового руху усієї сукупності мікрочастинок. В дійсності, всі мікрочастинки рухаються з різними швидкостями і можна поставити питання про розподіл мікрочастинок за швидкостями.
представляє собою середню характеристику теплового руху усієї сукупності мікрочастинок. В дійсності, всі мікрочастинки рухаються з різними швидкостями і можна поставити питання про розподіл мікрочастинок за швидкостями.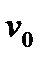 до
до  . Виражається дана вірогідність відношенням:
. Виражається дана вірогідність відношенням: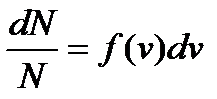 , (5)
, (5)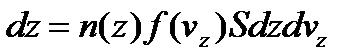 ,
, і займуть шар
і займуть шар  . При цьому, їх швидкості будуть лежати в інтегралі від
. При цьому, їх швидкості будуть лежати в інтегралі від 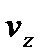 до
до 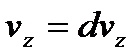 , але одне і те ж число молекул. Якщо прийняти, що
, але одне і те ж число молекул. Якщо прийняти, що 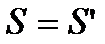 , то незмінність числа цих молекул виражається:
, то незмінність числа цих молекул виражається: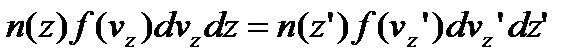 , (6)
, (6) - концентрація молекул газу на висоті
- концентрація молекул газу на висоті 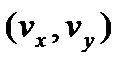 не будуть змінюватись, а зміна
не будуть змінюватись, а зміна 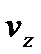 визначається законом збереження енергії, згідно якого:
визначається законом збереження енергії, згідно якого: .
.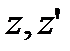 , отримаємо:
, отримаємо: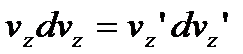 .
.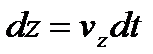 , а на висоті
, а на висоті 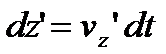 .
.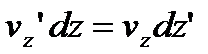 . (7)
. (7)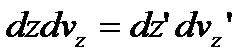 .
.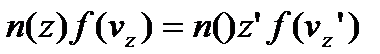 .
.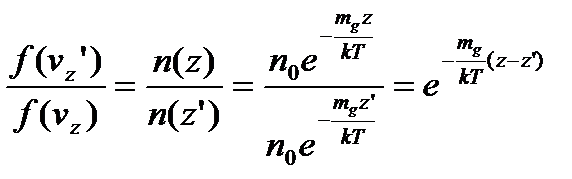 .
.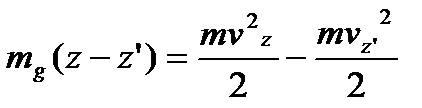 .
.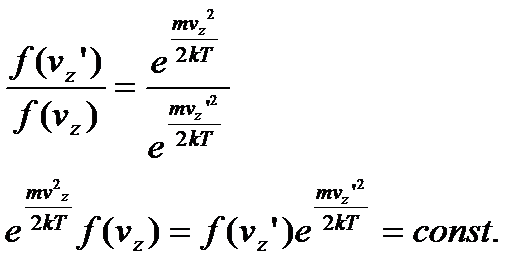
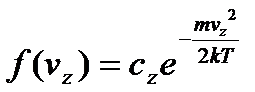 . (8)
. (8) .
.
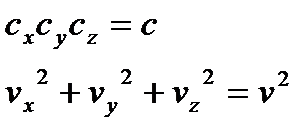
 . (9)
. (9)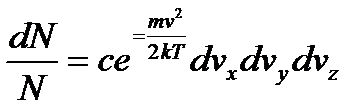 , (10)
, (10)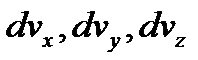 - об’єми нескінчено малого паралелепіпеда, що побудований в координатній системі простору швидкостей навколо точки з векторною координатою
- об’єми нескінчено малого паралелепіпеда, що побудований в координатній системі простору швидкостей навколо точки з векторною координатою  .
.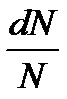 необхідно просумувати усі елементарні об’єми, що знаходяться на відстані
необхідно просумувати усі елементарні об’єми, що знаходяться на відстані  і ці об’єми заповнять шаровий прошарок між 2 нескінчено-близькими сферами з радіусами v i v+dv.
і ці об’єми заповнять шаровий прошарок між 2 нескінчено-близькими сферами з радіусами v i v+dv.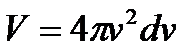 .
.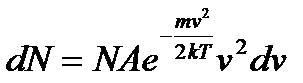 , (11)
, (11)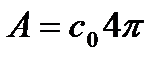 - деяка стала, що не залежить від швидкості молекул.
- деяка стала, що не залежить від швидкості молекул.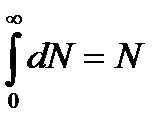 ,
,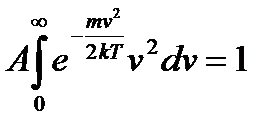 .
.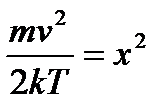 і скористатися значенням, що
і скористатися значенням, що 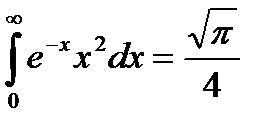 , то знайдемо:
, то знайдемо: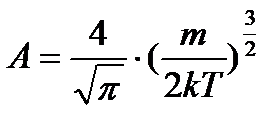 .
.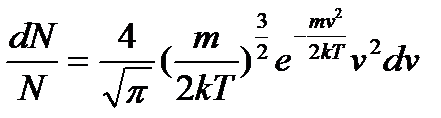 . (12)
. (12)

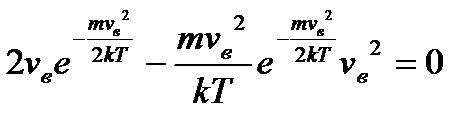 .
.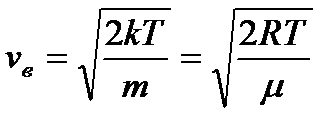 . (13)
. (13)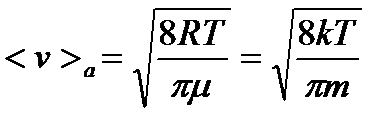 .
.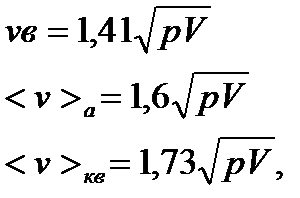
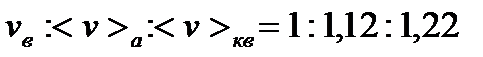 .
.