Адіабатичний процес відбувається без теплообміну з навколишнім середовищем.
Адіабатне розширення або стискання газу можна здійснити, помістивши його в циліндр із нетеплопровідними стінками і поршнем, і досить повільно переміщуючи поршень назовні або всередину циліндра. Стан системи при адіабатичному процесі можна змінити тільки за допомогою зміни зовнішніх параметрів.
Для цього процесу характерним є те, що газ увесь час залишається під зовнішнім тиском, який дорівнює пружності газу. Другою умовою адіабатичного процесу є теплоізольованість газу від навколишнього середовища.
Для адіабатичного процесу рівняння першого закону термодинаміки має вигляд:
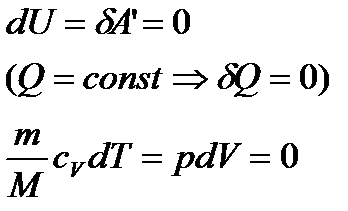 . (30)
. (30)
Виразимо P через V і T з рівняння стану ідеального газу:
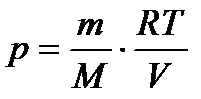 .
.
Підставимо в попереднє рівняння і скоротимо на відмінний від нуля множник 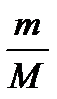 :
:
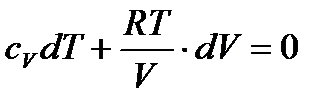 .
.
Розділимо обидві частини рівняння на 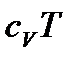 :
:
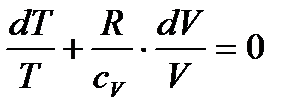 .
.
Це співвідношення можемо записати у вигляді:
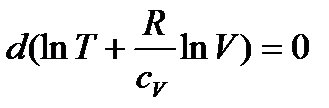 ,
,
звідси слідує, що при адіабатичному процесі:
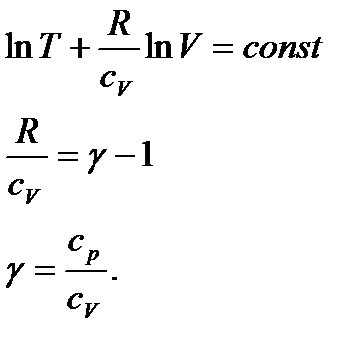
Проінтегрувавши і підставивши, одержимо:
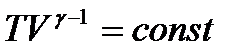 . (31)
. (31)
Це рівняння адіабатичного газу в змінних T і V:
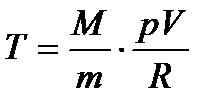 ,
,
враховуючи, що величини M,m і R – сталі:
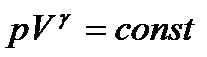 . (32)
. (32)
Це рівняння адіабатичного ідеального газу в змінних P і V (рівняння Пуассона).
При ізотермічному процесі (pV=const), тиск газу зменшується обернено-пропорційно об’єму в першому степені. При адіабатичному розширенні тиск зменшується обернено-пропорційно 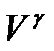 . Хід адіабати крутіший порівняно з ізотермою. Фізично це пояснюється тим, що при адіабатичному розширенні зменшення тиску зумовлене не тільки збільшенням об’єму, а й зменшенням температури.
. Хід адіабати крутіший порівняно з ізотермою. Фізично це пояснюється тим, що при адіабатичному розширенні зменшення тиску зумовлене не тільки збільшенням об’єму, а й зменшенням температури.

Рис. 6
Виведемо формули для розрахунку роботи при адіабатичному процесі: з попередніх викладок для 1 моль ідеального газу:
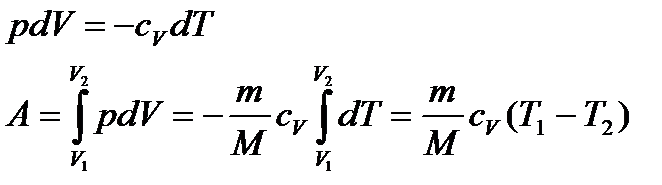 . (33)
. (33)
Оскільки
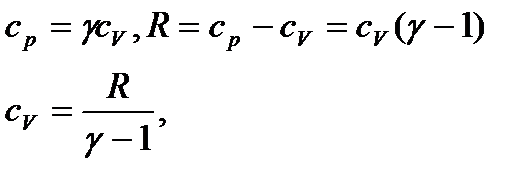 (34)
(34)
то:
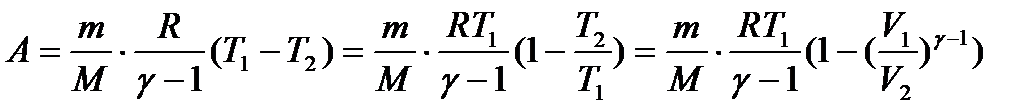 ,
,
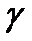 - показник адіабати,
- показник адіабати,
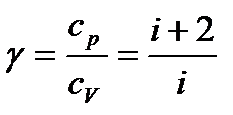 . (35)
. (35)
Графічно робота зображена площею заштрихованої трапеції.
Лекція 3

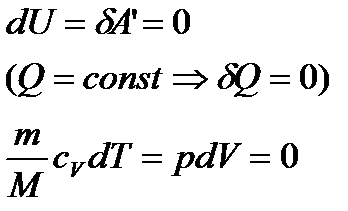 . (30)
. (30)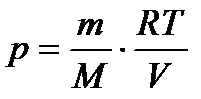 .
.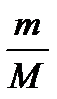 :
: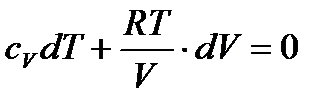 .
.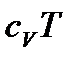 :
: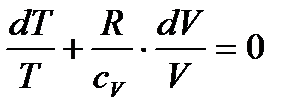 .
.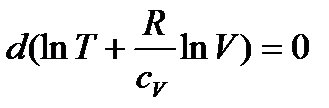 ,
,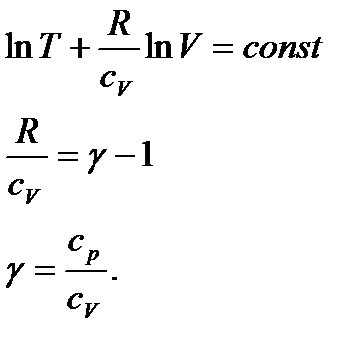
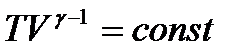 . (31)
. (31)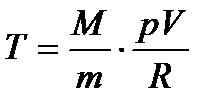 ,
,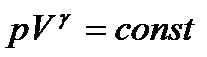 . (32)
. (32)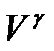 . Хід адіабати крутіший порівняно з ізотермою. Фізично це пояснюється тим, що при адіабатичному розширенні зменшення тиску зумовлене не тільки збільшенням об’єму, а й зменшенням температури.
. Хід адіабати крутіший порівняно з ізотермою. Фізично це пояснюється тим, що при адіабатичному розширенні зменшення тиску зумовлене не тільки збільшенням об’єму, а й зменшенням температури.
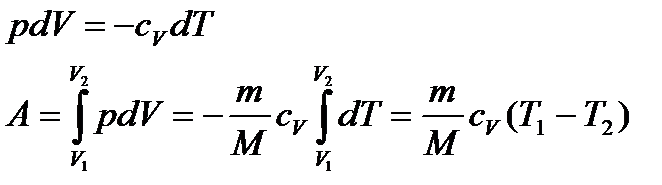 . (33)
. (33)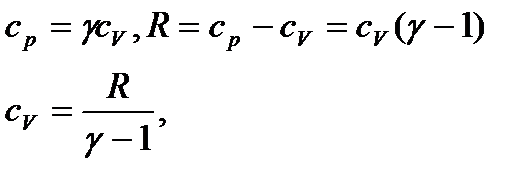 (34)
(34)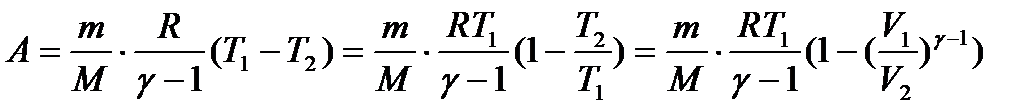 ,
,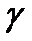 - показник адіабати,
- показник адіабати,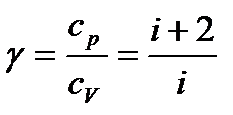 . (35)
. (35)