На сьогодні теорія гетерогенних реакцій розроблена значно слабше, ніж теорія гомогенних реакцій, хоча гетерогенні реакції мають дуже велике практичне значення.
Гетерогенними називаються реакції, в яких
реагуючі речовини перебувають у різних фазах,
тобто сама реакція проходить на межі
розподілу фаз.
До гетерогенних відносяться також процеси розчинення, кристалізації, випаровування, конденсації, електрохімічні процеси на границі електрод - розчин електроліту, гетерогенний каталіз.
Прикладом гетерогенної реакції є реакція розчинення речовини А у речовині В :
А(тв) + В(p)  АВ (р-р).
АВ (р-р).
Ця реакція проходить на межі поділу фаз А (тв) - розчин.
У загальному випадку гетерогенна реакція - це послідовність п’яти стадій (рис. 12.1), кожна з яких має свої особливості:
I - доставка речовини з глибини фази на поверхню поділу;
ІІ - адсорбція вихідних речовин на поверхні поділу;
ІІІ - власне хімічна реакція на поверхні поділу;
ІV - десорбція продуктів реакції з поверхні поділу;
V - відведення продуктів реакції із зони реакції углиб фази.
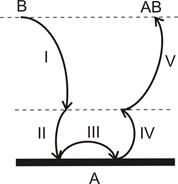
Рисунок 12.1 - Схема гетерогенної реакції
Кожна з цих стадій може бути лімітуючою, тобто мати дуже малу константу швидкості і найбільш чинити опір процесу. Для більшості гетерогенних реакцій найповільнішою стадією, яка визначає сумарну швидкість процесу, є підведення реагуючих речовин у реакційну зону (I). Дуже часто стадії ІІ - ІV об’єднують і розглядають як кінетичну область гетерогенної реакції.
Транспорт реагуючих речовин може здійснюватися конвекцією або дифузією. Конвекцією називають переміщення всього середовища в цілому. Конвекція розчину на границі з твердою поверхнею може відбуватися внаслідок переміщення твердого тіла або, частіше всього, через перемішування розчину.
Виключне значення при проходженні гетерогенних реакцій має дифузія. Тому зупинимося докладніше на загальному описі дифузійних процесів.

 АВ (р-р).
АВ (р-р).