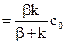Гетерогенними називаються реакції, в яких реагуючі речовини перебувають у різних фазах, тобто сама реакція проходить на межі розподілу фаз.
Прикладом гетерогенної реакції є реакція розчинення речовини А у речовині В :
А(тв) + В(p)  АВ (р-р).
АВ (р-р).
Ця реакція проходить на межі поділу фаз А (тв) - розчин.
У загальному випадку гетерогенна реакція - це послідовність п’яти стадій (см. рис.), кожна з яких має свої особливості:
I - доставка речовини з глибини фази на поверхню поділу;
ІІ - адсорбція вихідних речовин на поверхні поділу;
ІІІ - власне хімічна реакція на поверхні поділу;
ІV - десорбція продуктів реакції з поверхні поділу;
V - відведення продуктів реакції із зони реакції углиб фази.
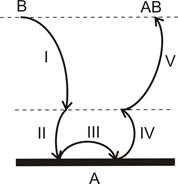
Схема гетерогенної реакції
Транспорт реагуючих речовин може здійснюватися конвекцією або дифузією. Конвекцією називають переміщення всього середовища в цілому. Конвекція розчину на границі з твердою поверхнею може відбуватися внаслідок переміщення твердого тіла або, частіше всього, через переміщення розчину.
Дифузією називається переміщення молекул речовини у нерухомому середовищі під дією градієнта концентрацій.
Розрізняють дифузію лінійну та просторову, нескінченну та обмежену, стаціонарну та нестаціонарну. Лінійна дифузія відбувається в одному напрямку, просторова - у різних напрямках. Дифузія називається нескінченною , якщо фронт дифузії у процесі гетерогенної реакції не встигає досягнути границі системи; дифузія є обмеженою, якщо фронт досягає границі системи. Під фронтом дифузії розуміють границю всередині розчину, де ще не помітні зміни концентрації, які спричинені процесом дифузії. При стаціонарній дифузії концентрація речовини в будь-якій заданій точці простору не змінюється з часом; при нестаціонарній - змінюється.
Гетерогенні процеси, як правило, здійснюються у перемішуваних розчинах, тобто доставка речовини до поверхні розподілу здійснюється шляхом конвекції. Однак, згідно з законами гідродинаміки, потік рідини поблизу поверхні твердого тіла уповільнюється, причому шар рідини молекулярних розмірів, безпосередньо прилеглий до поверхні, міцно утримується на ній. Це так званий дифузійний шар товщиною d, крізь який доставлення речовини до поверхні здійснюється тільки за рахунок дифузії. Всередині шару конвекція відсутня. Концентрація речовини у дифузійному шарі на границі з розчином дорівнює концентрації c0 в об’ємі розчину, а всередині дифузійного шару концентрація речовини зменшується до величини cs (рис. 12.2). Товщина дифузійного шару не є константою, а залежить від багатьох величин: щільності, в’язкості розчину, швидкості розчину, швидкості перемішування розчину.
Нехай швидкість стаціонарної дифузії і швидкість реакції на по верхні однакові. Нехай реакція на поверхні є реакцією першого порядку. Тоді для швидкості реакції W маємо
W = kcs 
де k - константа швидкості реакції першого порядку, b - константа швидкості дифузії.
Більшість твердофазних реакцій відносять до класу топохімічних. Топохімічною реакцією називається гетерогенна реакція, в якій бере участь хоча б одна тверда речовина і отримується хоча б один твердий продукт. Прикладами топохімічних реакцій є відновлення диоксиду германію воднем при отриманні напівпровідникового германію
GeO2(т) + 2Н2О(г) --> Ge(т) + 2Н2О(г),
термічне розкладання карбонату кальцію
СаСО3(т) --> СаО(т) + СО2(г).
Топохімічні реакції характеризуються специфічними кінетичними закономірностями. На початку топохімічної реакції швидкість її невелика (індукційний період), потім вона зростає, проходить через максимум та знижується практично до нуля. Ступінь перетворення при цьому звичайно змінюється за S - подібною кривою. Такий характер кінетичних закономірностей можна пояснити таким чином. У міру того як утворюються зародки фази твердого продукту реакції, з’являється реакційна поверхня поділу фаз, яка зростає у часі як внаслідок зростання зародків, що є, так і внаслідок утворення нових зародків.
Відповідно до цього швидкість реакції на початку процесу мала, а потім зростає. З розвитком поверхні поділу фаз зростаючі зародки продукту починають зливатися. Внаслідок відсутності вільної поверхні утворення нових зародків практично не відбувається. Тому площа реакційної поверхні поділу твердих фаз і відповідно швидкість реакції проходять через максимум. У подальшому злиття зародків приводить до зменшення реакційної поверхні та утворення суцільного шару твердого продукту, границя якого поступово просувається в глибину зерна вихідної твердої речовини. При цьому швидкість реакції поступово спадає до нуля.
Каталізом називається змінювання швидкості хімічних реакцій за наявності речовин, які називаються каталізаторами, які , беручи участь у процесі, самі наприкінці реакції залишаються хімічно незмінними.
Каталітичні реакції дуже різноманітні, однак до цих пір не існує загальної теорії каталізу. Зазначимо деякі загальні властивості каталітичних реакцій:
1 Дія каталізатора на реакцію не відбивається на її стехіометричному рівнянні. Однак у першому наближенні швидкість реакції прямо пропорційна кількості каталізатора.
2 Каталізатор не зміщує хімічної рівноваги. Якщо реакція оборотна, то каталізатор рівною мірою змінює швидкість прямої та оборотної реакцій.
3 Каталізатор має специфічність дії. Він може змінювати швидкість однієї реакції та не впливати на швидкість іншої.
4 Деякі речовини (не каталізатори) посилюють дію каталізатора, інші - послаблюють. Такі речовини називаються промоторами та ядрами.
За наявності каталізатора реакція прискорюється, тобто збільшується константа швидкості реакції:
k = Z × e-Ea/RT× eSa/R.
Таким чином, каталізатор збільшує швидкість реакції за рахунок зменшення енергії активації Еа або збільшення ентропії активації Sa .
Ключові терміни
Гетерогенни процеси; конвекція; дифузія; рівняння Фіка; топохімічні реакції; каталіз.
Питання для самоперевірки
1. Познайомтесь Дайте визначення гетерогенної реакції.
- Намалюйте загальну схему гетерогенної реакції і виділіть її основні стадії.
- Дайте визначення дифузії. Проведіть класифікацію дифузійних процесів.
- Напишіть рівняння Фіка і охарактеризуйте величини, що входять в ці рівняння.
- Розгляньте кінетику гетерогенної реакції при стаціонарної лінійної дифузії.
- Познайомтесь з основними висновками теорії, що описує перебіг реакцій при нестаціонарної лінійної дифузії.
- Які реакції називаються «топохімічними»? Опишіть основні особливості кінетики таких реакцій.
- Дайте визначення поняттю «каталіз». Перелічіть загальні властивості каталітичних реакцій.
- Визначте гомогенний і гетерогенний каталіз. Наведіть приклади.
- Назвіть причини впливу каталізаторів на швидкість хімічних реакцій.

 АВ (р-р).
АВ (р-р).