1.2.4.а. Ізотермічний
Ізотермічний процес здійснюється при сталій температурі системи (Т=const), при m=const, n=const. При 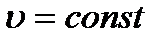 , рівняння Менделєєва-Клайперона запишемо:
, рівняння Менделєєва-Клайперона запишемо:
pV=const. (16)
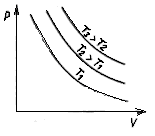

Рис. 3
Ізотермічні процеси відбуваються досить повільно. При цьому поняття температури не втрачає сенсу. Стискаємість ідеального газу при T=const характеризується ізотермічним коефіцієнтом стискаємості χ, який визначається як відносна зміна об’єму, що зумовлює зміну тиску на одиницю:
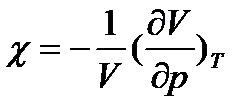 , (17)
, (17)
де V – початковий об’єм;
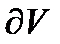 - зміна об’єму, яка зумовлює зміну тиску на
- зміна об’єму, яка зумовлює зміну тиску на 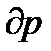 .
.
Знайдемо коефіцієнт χ для ідеального газу. Продиференціювавши (16) при T=const, дістанемо:
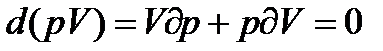 ,
,
звідси:
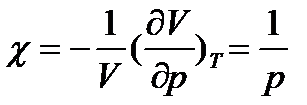 (18)
(18)
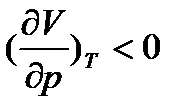 ,
,
тобто при 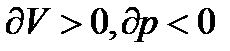 , тоді
, тоді  ,
, 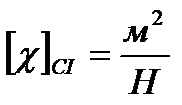 .
.
Для реалізації ізотермічного процесу треба забезпечити ідеальний тепловий контакт між газом і термостатом (тілом, що має сталу температуру).
Оскільки 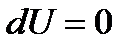 , то перший закон термодинаміки для ізотермічного процесу:
, то перший закон термодинаміки для ізотермічного процесу:
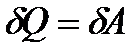 . (19)
. (19)
Роботу  визначають:
визначають:
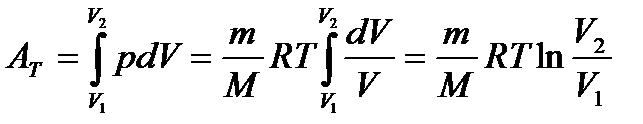 . (20)
. (20)
З урахуванням (20), рівняння (19) перепишемо так:
 . (21)
. (21)
1.2.4.б. Ізобарний
Ізобарний процес відбувається в системі при сталому тиску (P=const).
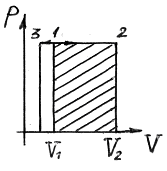

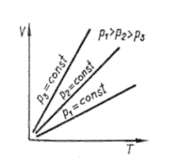
Рис. 4
Такий процес можна здійснити, коли газ, наприклад, міститься в циліндрі з рухомим поршнем. Зміна температури газу в такому циліндрі зумовлює переміщення поршня, тобто зміну об’єму. Тиск при цьому залишається сталим:
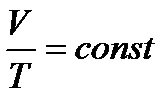 . (22)
. (22)
Це рівняння ізобарного процесу, виражає закон Гей-Люссака:
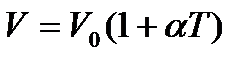 ,
,
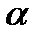 - коефіцієнт об’ємного розширення газу,
- коефіцієнт об’ємного розширення газу,  = 0,003661
= 0,003661 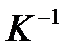 .
.
Аналогічно, коефіцієнт χ:
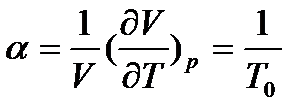 .
.
Розглянемо графік p(V): газ, поміщений в циліндр із вільно-рухомим поршнем, під час нагрівання  або під час охолодження
або під час охолодження 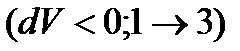 здійснює ізобарний процес.
здійснює ізобарний процес.
Елементарна робота:
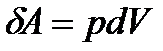 (23)
(23)
є повним диференціалом деякої функції. Оскільки p=const, то робота є однозначною функцією параметрів початкового і кінцевого станів системи (параметр V). Звідси:
 . (24)
. (24)
Диференціюючи рівняння Менделєєва-Клайперона при сталому тиску, одержимо:
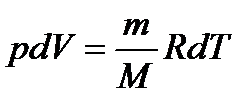 ,
,
тоді:
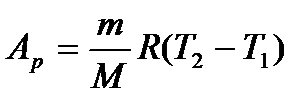 .
.
Кількість теплоти, якою газ обмінюється в ізобарному процесі при незалежності 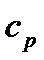 від температури:
від температури:
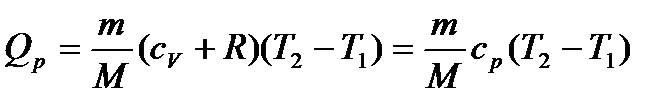 . (25)
. (25)
Кількість теплоти 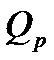 йде не тільки на збереження внутрішньої енергії, а й на виконання роботи щодо розширення газу:
йде не тільки на збереження внутрішньої енергії, а й на виконання роботи щодо розширення газу:
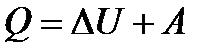 (26)
(26)
1.2.4.в. Ізохорний
Ізохорний процес відбувається при сталому об’ємі газу (V=const):
 . (27)
. (27)
Це рівняння ізохорного процесу.
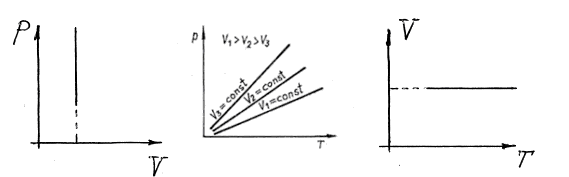
Рис. 5
За законом Шарля, рівняння ізохорного процесу також можна записувати у вигляді:
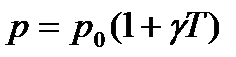 ,
,
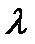 - термічний коефіцієнт тиску (
- термічний коефіцієнт тиску ( 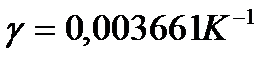 ).
).
Аналогічно до коефіцієнту 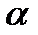 :
:
 .
.
Зв’язок між коефіцієнтами 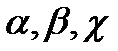 :
:
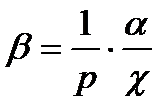 .
.
Робота в ізохорному процесі дорівнює нулю:
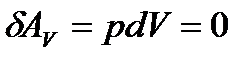 (28)
(28)
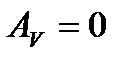 .
.
Тоді рівняння першого закону термодинаміки:
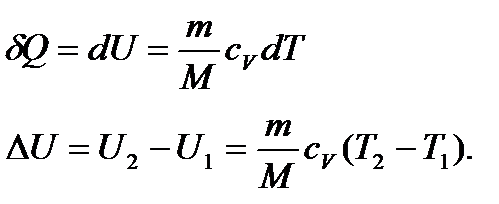 (29)
(29)

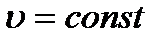 , рівняння Менделєєва-Клайперона запишемо:
, рівняння Менделєєва-Клайперона запишемо:

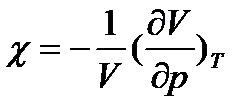 , (17)
, (17) - зміна об’єму, яка зумовлює зміну тиску на
- зміна об’єму, яка зумовлює зміну тиску на  .
.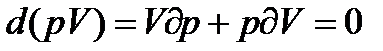 ,
, (18)
(18) ,
, , тоді
, тоді  ,
,  .
.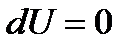 , то перший закон термодинаміки для ізотермічного процесу:
, то перший закон термодинаміки для ізотермічного процесу: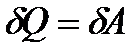 . (19)
. (19) визначають:
визначають: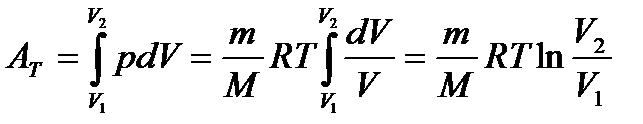 . (20)
. (20) . (21)
. (21)


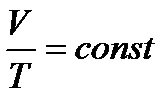 . (22)
. (22)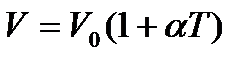 ,
,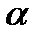 - коефіцієнт об’ємного розширення газу,
- коефіцієнт об’ємного розширення газу,  = 0,003661
= 0,003661 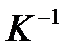 .
.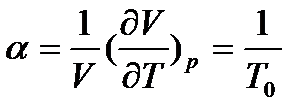 .
. або під час охолодження
або під час охолодження 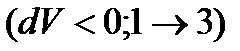 здійснює ізобарний процес.
здійснює ізобарний процес.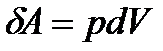 (23)
(23) . (24)
. (24)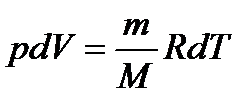 ,
,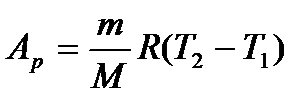 .
.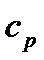 від температури:
від температури: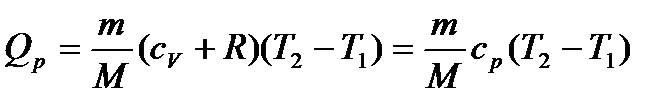 . (25)
. (25)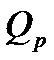 йде не тільки на збереження внутрішньої енергії, а й на виконання роботи щодо розширення газу:
йде не тільки на збереження внутрішньої енергії, а й на виконання роботи щодо розширення газу: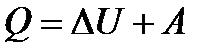 (26)
(26) . (27)
. (27)
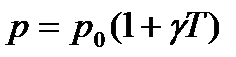 ,
, - термічний коефіцієнт тиску (
- термічний коефіцієнт тиску ( 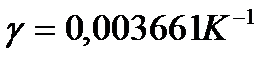 ).
). :
: .
.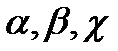 :
: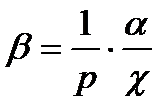 .
.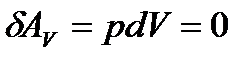 (28)
(28)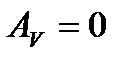 .
.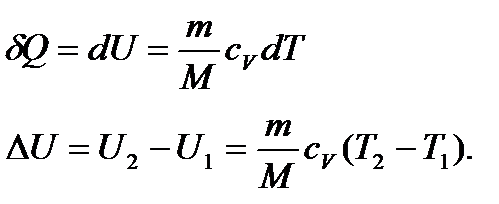 (29)
(29)